Bitte Warten
Das Laden der Strukturdaten dauert einen Augenblick. Bitte haben Sie etwas Geduld!
0 von 0 Strukturen wurden bereits geladen.
Es ist aber wahrscheinlich, dass sich beim Umzug doch das ein oder andere Problem eingeschlichen hat. Bitte meldet Probleme inkl. möglicht genauer Beschreibung und evtl. eines Screenshots an Klaus Schaper.
MO-Schema von Ethin
Studienfach:
Alle_Veranstaltungen
Zielgruppe
Dieses Lernmodul richtet sich an Studierende mit dem Hauptfach Chemie (Studierende der Biochemie, Chemie, und Wirtschaftschemie) und geht über den Lernstoff im Nebenfach (Studierende der Biologie und Medizin) hinaus.
Lernziel
Nach der Bearbeitung dieses Moduls sollten Sie
- die Grundlagen der MO-Theorie kennen,
- Vor- und Nachteile der Molekülorbitaltheorie gegenüber der Hybridorbitaltheorie benennen können,
- das MO-Schema des Ethin-Moleküls erläutern können,
- in der Lage sein weitere MO-Schemas zu interpretieren.
Einleitung
Die Molekülorbitaltheorie von Friedrich Hund und Robert S. Mulliken ist eine Möglichkeit die Bindungsstruktur von Molekülen zu beschreiben. Nach der Molekülorbitaltheorie auch MO-Verfahren werden die Atomorbitale (AOs) der beteiligten Atome so vermischt, dass sie sich in bindende und antibindende Molekülorbitale (MOs) aufspalten. Dieses Vermischen geschieht mathematisch durch eine Linearkombination der Atomorbitale. Sie werden als Elektronenwolken dargestellt und sind über das gesamte Molekül delokalisiert.
Anhand der Verbindung Ethin sollen in diesem eLearning-Modul, wesentliche Inhalte der Molekülorbitaltheorie erarbeitet und veranschautlicht werden.
Die Molekülorbitaltheorie

Abbildung: allgemeines MO-Schema eines Moleküls AB
Das Aussehen und der Energiegehalt der Molekülorbitale lässt sich mathematisch mit Hilfe des LCAO-Modells (linear combination of atomic orbitals) näherungsweise bestimmen. Sie ergeben sich aus Addition bzw. Subtraktion der Wellenfunktionen der Atomorbitale. Bei größeren Molekülen setzen sich die Orbitale aus der Linearkombination der verschiedenen Atomorbitale zusammen.
Bei der Darstellung eines Molekülorbitals aus der Linearkombination zweier Atomorbitale entsteht ein bindendes Molekülorbital mit geringerer Energie als das energieärmere Atomorbital und ein antibindendes MO, welches über dem energiereicheren AO liegt (Abbildung rechts). Der Grad der Aufspaltung kann näherungsweise mit Hilfe der Überlappung der AOs bestimmt werden. Allgemein spalten σ-Bindungen stärker auf, als π-Bindungen.
Bindende und antibindende Molekülorbitale
Bindende Molekülorbitale werden in σ- bzw. π-Orbitale unterteilt, die zugehörigen antibindenden Orbitale werden mit einem Stern (σ*, π*) gekennzeichnet. Sie sind in erster Näherung um den gleichen Energiebetrag heraufgesetzt, wie bindende Molekülorbitale abgesenkt sind.
| Bindende Molekülorbitale entstehen durch Addition der beiden Atom-Wellenfunktionen (Die einzelnen Wellenfunktionen sind in rot, bzw. blau gezeigt, die Summe in schwarz). Die Ladungs- bzw. Elektronendichte liegt hier zwischen den beteiligten Atomkernen, es entsteht eine bindende Wechselwirkung (Bild rechts). |
.png)
|
|
Antibindende Molekülorbitale werden durch die Subtraktion der Wellenfunktionen gebildet.
Zwischen den Bindungspartner ergibt sich eine Knotenfläche. Der daraus resultierende
Elektronenmangel führt zu abstoßenden Wechselwirkungen zwischen den
Kernen. (Bild rechts) |
.png)
|
Werden sowohl die bindenden Orbitale, wie auch die korrespondierenden antibindenden Orbitale mit Elektronen besetzt (vgl. das Heliummolekül), kommt keine Bindung zustande.
Die σ-Bindung
Eine Bindung, die rotationssymmetrisch zur Bindungsachse liegt wird als σ-Bindung bezeichnet. σ-Bindungen können sich aus s-, p-, d-Orbitalen und deren Hybriden bilden. (siehe Abbildung unten).

Darstellung der unterschiedlichen s- und p-Orbitale, die Darstellung des dz² fehlt.
Aufbau des Moduls
Das Modul beschäftigt sich genauer mit der Bindungsstruktur des Ethin-Moleküls. Dazu wird auf die bereits bekannte "LCAO-Darstellung" und die Hybridorbital-Theorie im Vergleich zur Molekül-Orbitaltheorie zurückgegriffen.
Nach Anklicken des Button "Seite ausrichten und starten!", sollte die Seite nun optimal ausgerichtet sein. Sie sehen dann das
aktuelle Arbeitsfenster indem Sie gerade lesen in oprimaler
Größe und darunter die Animation und die Grafik.
Wenn Sie das Fenster versehentlich verschieben, wählen Sie
"erneut ausrichten" in der rechten Spalte. Auf rechten Seite finden Sie außerdem
den Button "Ansicht fixieren", mit dessen Hilfe Sie die Scrollbar fixieren können.
Unten links ist das Ethin-Molekül gezeigt. Es kann mit Hilfe der Maus beliebig gedreht und mittels Mausrad vergrößert, wie verkleinert werden.
Hybrid-Orbitale:
Die Hybrid-Orbitale
können mit Hilfe der Button oberhalb der Abbildung
ausgewählt werden. Anhand der
Schieberegler lassen Atomradius, Bindungsdicke, Hybrid-Orbitalgröße,
Molekülorbitalgröße und Transparenz verändern.
MO-Theorie
Das in der rechten
Spalte abgebildete MO-Schema stellt die wesentlichen bindenden und
antibindenden Molekülorbitale des Ethin-Moleküls dar.
Ethin und die Hybridorbital-Theorie
Betrachten Sie das Ethin-Molekül:
Zur einheitlicheren Darstellung wird im weiteren Verlauf von der Orientierung des jmol-Applet ausgegangen. Dabei bildet die Bindungsachse die z-Achse.-
Zu Beginn aktivieren und deaktivieren Sie einzelne
"Hybrid-Orbitale", indem Sie die Button über der Animation
bedienen.
Tipp: Sollte die Button-Leiste nicht zu sehen sein, betätigen Sie den Button "Hybrid-Orbital-Theorie-Buttonleiste" links neben dem animierten Molekül. - Betrachten Sie die beiden π-Bindungen (hellgrün, grün) und vergleichen Sie die Anordnung der Orbitallappen beider π-Systeme.
- Verändern Sie die Größe der Orbitale, bis sich die Orbitallappen überschneiden und verändern Sie die Transparenz
Ethin und die sp-Hybridisierung
Die Animation stellt die jeweiligen Atomorbitale und deren Überschneidung dar. Die Überlappung der freien py- und px-Orbitale zur π-Bindung kann durch die Vergrößerung der Orbitallappen verdeutlicht werden.
Laut Hybridorbital-Theorie ist das Ethin-Molekül sp-hybridisiert. Pro Kohlenstoffatom bilden ein 2s- und ein 2pz-Orbital zwei sp-Hybridorbitale. Es entstehen also insgesamt vier sp-Hybridorbitale. Eins ist jeweils an der Wasserstoff-Kohlenstoff-σ-Bindung (gelb und magenta) beteiligt, die beiden verbleibenden Hybridorbitale bilden die Kohlenstoff-Kohlenstoff-σ-Bindung (rot). Die unbeteiligten 2py- (grün) und 2px-Orbitale (hellgrün) stehen senkrecht zur Bindungsachse und sind um 90 °Grad gegeneinander verdreht. Sie bilden die beiden π-Bindungen, die die σ-Bindung umschließen.
Hybridorbital-Modell und MO-Modell
Gebildete Hybridorbitale sind im Sinne der Hybridorbitaltheorie energetisch
gleich. Daher sollten auch die beiden C—H-σ-Bindungen energetisch
gleich sein. Das MO-Schema (rechts) zeigt jedoch, dass die Molekülorbitale
aller drei σ-Bindungen nicht energiegleich sind. Die Hybridisierung führt
zwar zu lokalisierten Bindungen und ist daher in der organischen Chemie hilfreich,
aber die korrekte energetische Lage der Orbitale und die tatsächliche
Gestalt der Orbitale kann nicht vorhergesagt werden.
Solche Vorhersagen sind mit Hilfe des MO-Modells möglich.
Bei Betrachtung und Interpretation eines MO-Schemas helfen die folgenden
Gesetzmäßigkeiten:
- Je höher das "Niveau" der beteiligten Elektronen, desto energiereicher ist das resultierende Molekülorbital: 1s < 2s < 2sp < 2sp2 < 2sp3 < 2p < ..
- Je mehr Knotenebene das MO aufweist, desto energiereicher ist es.
- Die korrespondierenden antibindenden MOs liegen deutlich höher.
Das MO-Diagramm von Ethin
Die Molekülorbitale (MO) werden durch Linearkombination aus den Atomorbitalen gebildet. Dargestellt sind alle bindenden und die korrespondierenden antibindenden MOs.
- Verschaffen Sie sich einen Überblick, indem Sie die unterschiedlichen Energiebalken im Diagramm anklicken. Auf der linken Seite wird das entsprechende MO animiert.
- Drehen Sie das Molekül, verkleinern Sie den Atomradius
(Kugelgröße) und verändern
Sie die Orbitalgröße um einen besseren Einblick in die Struktur der
MOs zu erhalten.
Tipp: Sollte die Button-Leiste nicht zu sehen sein, betätigen Sie den Button "Molekü-Orbital-Theorie-Buttonleiste" links neben dem animierten Molekül. - Mit Hilfe des Orbital-Reset-Button lässt sich anschließend der Ausgangszustand wiederherstellen.
- Betrachten Sie nun zu Beginn die MOs auf den untersten Energiebalken (schwarz).
1s-Orbitale des Kohlenstoffs
Bei den beiden dargestellten Orbitalen handelt es sich um das bindende
und das antibindende MO aus den 1s-Orbitalen der Kohlenstoffatome.
Wie an der Energieachse abzulesen, liegen sie energetisch weit unter den anderen MOs.
Die Wechselwirkung zwischen den beiden 1s-Orbitalen ist so klein,
dass beide Orbitale näherungsweise energiegleich sind. Es entsteht
ein σ- und ein σ*-Orbital, die beide
vollständig mit Elektronen besetzt sind.
Die bindende und antibindende Wirkung heben sich gegenseitig auf.
Es entsteht keine Bindung!
Das Ethinmolekül enthält insgesamt drei weitere σ-Bindungen, die sich aus den s- und pz-Orbitalen der Kohlenstoffatome, sowie den s-Orbitalen der Wasserstoffatome bilden. Die Atomorbitale mischen zu unterschiedlichen Anteilen miteinander, so dass die einzelnen Atomorbitale an der Bildung mehrerer Molekülorbitale beteiligt sind. Je höher der Anteil der p-Orbitale, desto energiereicher ist das MO.
- Betrachten Sie nun das erste der σ-MOs (σ1).
- Verkleinern Sie den Kugelradius und schauen Sie sich die innere Struktur des Orbitals an.
- Verändern Sie die Größe des MOs und drehen Sie das Molekül.
- Tipp: den besten Einblick erhalten Sie, wenn Sie das MO möglichst klein machen und das Molekül seitlich drehen. Nutzen Sie auch die verschiedenen Darstellungsmöglichkeiten (Gitternetz, Transparenz und Füllung).
Die σ-Bindungen: C—C-σ-Bindung, Teil I
Das energieärmste σ-Orbital (1) wird überwiegend aus den 2s-Orbitalen der Kohlenstoffatome und einem geringen Anteil der pz-Orbitale gebildet. Der Beitrag der Wasserstoff-1s-Orbitale ist vernachlässigbar klein. Das MO ist demnach vorwiegend zwischen den beiden Kohlenstoffatomen bindend und entspricht näherungsweise der C—C-σ-Bindung.
Durch Verkleinern des Atomradius und Verändern der Orbitalgröße kann man die kugelförmigen s-Orbitalstrukturen erkennen. Die Knotenflächen, die beim Mischen der 2s-Orbitale mit den pz-Orbitalen entstehen, befinden sich zwischen dem roten und blauen Teilen des gezeigten Orbitals. Der rote Teil ist kernnah und kann nur erkannt werden, wenn die Atome hinreichend klein dargestellt sind.
Die fachliche Erläuterung zu der Zusammensetzung des Orbitals folgt nun in Kapitel 11.
Die σ-Bindungen: C—C-σ-Bindung, Teil II
Durch das Mischen des 2s-Orbitals (Abb.: 1a) mit einem kleinen Anteil des 2pz-Orbitals (Abb.: 1b) an einem Kohlenstoffatom entsteht ein Orbital, welches immer noch einem 2s-Orbital ähnelt (Abb.: 1d). Allerdings ist dieses Orbital verzerrt. Reduziert man die Orbitalgröß stark (Es wird nur der Bereich angezeigt, indem sich die Elektronen mit einer hohen Wahrscheinlichkeit befinden), so ähnelt das Orbital einem sp-Orbital (Abb.: 1e). Besser kann man dieses Orbital als spn Orbital bezeichnen, bei dem n deutlich kleiner als 1 ist (In der klassischen Theorie der Hybridisierung kennt man in der Regel nur natürliche Zahlen für n).

Dieses Mischen liefert an jedem Kohlenstoffatom eine Linearkombination der beiden Orbitale. Diese beiden Orbitale überlappen bindend, so dass eine C—C-σ-Bindung entsteht (Abb.: 2). Abbildung 2a entspricht 1d, Abbildung 2b entspricht 1e. Abb.: 2c zeigt einen Screenshot mit den entsprechenden Einstellungen.


Zusätzlich haben die beiden 1s-Orbitale an den beiden
Wasserstoffatomen kleine Koeffizienten. Diese sieht man nur, wenn die
Orbitalgröße relativ hoch gewählt ist (Es wird auch der Bereich
angezeigt, indem sich die Elektronen nur mit einer geringen Wahrscheinlichkeit
befinden).
Diese Orbitale überlappen bindend mit der C—C-σ-Bindung. Daher hat dieses
Orbital zusätzlich einen schwachen C—H-bindenden Charakter (Abb.: 3).
Rechts sehen sie einen Screenshot des Orbitals.


Im nächsten Kapitel geht es nun um die Bildung der C—H-Bindung.
Die σ-Bindungen: C—H-σ-Bindung I
Vergleichen Sie nun die beiden weiteren σ-MOs (σ2 und σ3).
- Klicken Sie dazu entsprechenden Energieniveaus (grün) nacheinander an.
- Verkleinern und vergrößern Sie den Orbitalradius der beiden MOs
- Tipp: um einen besseren Eindruck über die beteiligten Atomorbitale zu erhalten, ist es wieder hilfreich mit einem geringen Kugelradius der Atome zu arbeiten.
An der Verteilung der Elektronendichte (Elektronenwolke) entlang der Molekülachse lässt sich bereits erkennen, dass die beiden MOs (σ2 und σ3) insbesondere die C—H-σ-Bindungen ausbilden (dort findet man große Orbitalkoeffizienten).
Betrachten wir zunächst das σ2-Orbital (das untere der beiden grünen Orbitale):

In Abbildung 1a) ist noch einmal das σ1-Orbital (blaues Energielevel) dargestellt. Die Orbitale an jedem Zentrum sind durch eine Linearkombination aus s-Orbital und p-Orbital entstanden. Neben einer additiven Linearkombination gibt es auch eine suptraktive Liniearkombination (vergleiche Kapitel 2). Hier weisen die großen Orbitallappen nach außen. Zwei solche Orbitale kombinieren in σ2 antibindend (siehe 1b). Es gibt einen Knoten zwischen den Kohlenstoffatomen. Zusätzlich gibt es große Orbitalkoeffizienten an den Wasserstoffatomen (siehe 1c). Dies führt zu einer schwachen antibindenden Wechselwirkung zwischen den Kohlenstoffatomen und einer bindenden Wechselwirkung zwischen Kohlenstoff und Wasserstoff.
Die σ-Bindungen: C—H-σ-Bindung II
Das σ3-Molekülorbital (das obere der beiden grünen
σ-Orbitale) hat im Gegensatz zu den beiden zuvor
diskutierten σ-Orbitalen einen sehr kleinen 2s-Anteil an den
Kohlenstoffatomen und einen hohen 2p-Anteil. Genauer gesagt sind die
p-Orbitale beteiligt, die auf der C—C-Bindungsachse liegen
(pz-Orbitale).
Dadurch entsteht eine bindende Wechselwirkung zwischen den beiden
Kohlenstoffatomen.
Zusätzlich gibt es Orbitalkoeffizienten an den beiden 1s-Orbitalen der beiden Wasserstoffatome. Auch diese führen zu einer bindenden Wechselwirkung.

Abbildung 1a zeigt das beteiligte p-Orbital am linken Kohlenstoffatom, Abbildung 1b das entsprechende Orbital am rechten Kohlenstoffatom, Abbildung 1c die beiden beteiligten s-Orbitale an den beiden Wasserstoffatomen. In Abbildung 1d ist die bindende Wechselwirkung zwischen diesen Orbitalen gezeigt. Die Atomorbitale (1a bis 1c) sind in ihrer Phase so gewählt, dass sie Abbildung 1d entsprechen.
- Vergleichen Sie das so konstruierte Orbital mit dem berechneten im Fenster unten.
Die π-Bindungen
- Betrachten Sie nun die beiden energiegleichen, besetzten π-Orbitale (untere roten Energiebanden).
- Drehen Sie das Molekül mehrfach, um die rämliche Anordnung der bindenden Orbitale besser zu erkennen.
- Vergleichen Sie die beiden π-Orbitale mit den σ-Orbitalen.
- Tipp: Die Achsen helfen bei der Orientierung:
Betrachten wir nun das Linke der beiden π-Orbitale (siehe Energieschema rechts und Abb. 1a). Dies ist in y-Richtung orientiert und die x-z-Ebene ist eine Knotenebene. Dieses Orbital entseht durch die Überlappung der beiden py-Orbitale an den beiden Kohlenstoffatomen.

Im Gegensatz dazu ist dasRechte der beiden π-Orbitale (siehe Energieschema rechts und Abb. 1b) in x-Richtung orientiert und die y-z-Ebene ist eine Knotenebene. Dieses Orbital entseht durch die Überlappung der beiden px-Orbitale an den beiden Kohlenstoffatomen.




Darstellung der beiden π-Bindungen: Seitenansicht der π-py-Bindung (links)
und der π-px-Bindung (2.v.li.),
Vorderansicht der π-py-Bindung (2.v.re.) und der π-px-Bindung (rechts).
Wenn man das Molekül so dreht, dass man es entlang der Bindungsachse betrachtet (alle Atome liegen exakt hintereinander), kann man besonders gut erkennen, dass die π-Orbitale othogonal liegen (siehe Abbildung oben).
Zusammenfassung
In den vorangegangenen Abschnitten haben wir die besetzten Orbitale betrachtet. Die Ergebnisse sollen nach einmal kurz zusammengefasst werden:
- Die beiden untersten Molekülorbitale (schwarz) sind durch Linearkombination der 1s-Orbitale an beiden Kohlenstoffatomen entstanden. Typischerweise werden diese bei der Diskussion der Bindungsverhältnisse nicht berücksichtigt, weil man sich auf die Valenzelektronen beschränkt.
- Eines der beiden Orbitale ist bindend (links), das andere ist antibindend. In Summe ist der Beitrag, den beide Orbitale leisten, also 0. Daher werden diese Orbitale bei der Betrachtung der Bindungsverhältnisse üblicherweise vernachlässigt.
- Alle drei darüberliegenden Molekülorbitale (blau und grün) bilden das σ-Gerüst. Das σ1-Orbital ist C—H- und C—C-bindend, dass σ2-Orbital ist C—H-bindend und C—C-antibindend und das σ3-Orbital ist wieder C—H- und C—C-bindend.
- In Summe ergibt sich daraus eine C—C-Bindung und zwei C—H-Bindungen.
- Im Gegensatz zu einer einfachen Betrachtung basierend auf der Hybridisierung existieren aber keine lokalisierten Bindungen, die den Valenzstrichen in einer Valenzstrichformel (Lewis-Schreibweise) entsprechen.
- Darüber liegen die beiden entarteten (energiegleichen) π-Orbitale.
Die π*-Orbitale
Oberhalb der besetzten Orbitale folgen die unbesetzten Orbitale. Diese sind antibindend, wie es für unbesetzte Orbitale in organischen Molekülen typisch ist.
- Wählen Sie die beiden π*-Orbitale aus und betrachten Sie diese.
Die ersten beiden unbesetzten, antibindenden Orbitale sind die beiden π*-Orbitale. Diese sind wie auch schon die π-Orbitale entartet und stehen orthogonal zueinander. Verglichen mit den π-Orbitalen (Abbildung 1a) besitzen die π*-Orbitale (Abbildung 1b) eine zusätzliche Knotenebene (Zur Entstehung einer Knotenebene: siehe Kapitel 2).

- Vergleichen sie die Fäbung der Orbitallappen der π- und π*-Orbitale miteinander.
- Tipp: Es ist sinnvoll jeweils die übereinanderliegenden π- und π*-Orbitale zu vergleichen.
Die antibindenden Wechselwirkungen lassen sich am Beispiel der π- und π*-Orbitale
sehr gut veranschaulichen.
Während bei den bindenden π-Orbitalen die beiden
Wellenfunktionen addiert werden, die rot bzw. blau gefärbten der Orbitallappen stehen auf der gleichen Seite (1a),
werden bei den π*-Orbitalen die Wellenfunktionen voneinander subtrahiert, die gleichgefärbten
Orbitallappen stehen diagonal zueinander (1b).
Beispiel: Die bindende Wechselwirkung π-Bindung ist durch große Elektronenwolken oberhalb und unterhalb der C—C-Achse
dargestellt(siehe die Abbildung unten links). Die zusätzliche Knotenebene zwischen den Kohelnstoffatomen lässt dagegen
die ursprünglichen Orbitallappen die zum π*-Orbital führen erkennen. Sie erinnern an vier einzelne Ballons (vgl. Abbildung unten mitte).


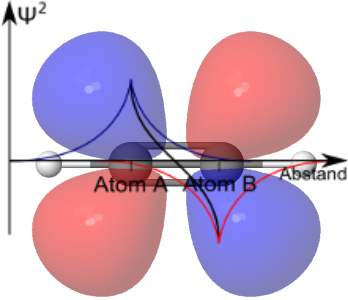
Abbildung der π-Bindung (links) und des π*-Orbitals (mitte). Die zusätzliche Knotenebene senkrecht zur
C—C-Bindungsachse lässt sich in der Darstellung gut erkennen (rechts).
Die σ*-Orbitale - Orbital 1
Die σ*-Orbitale wirken auf den ersten Blick sehr komplex. Vergleicht man diese aber mit den entsprechenden σ-Orbitalen, so kann das Zusammenkommen der Orbitale verstanden werden.
- Beginnen Sie mit dem Vergleich der σ- und σ*-Orbitalen, indem sie zunäst das bindende σ2-Orbital (untere grüne Linie) aktivieren.
- Drehen Sie das Molekül so, dass der rote Orbitallappen nach rechts zeigt. Nutzen Sie die Schaltfläche zur Verringerung des Atomradius um die kernnahen verkleinerten Orbitallappen sichtbar zu machen.
- Betrachten Sie anschließend die untere σ*-Linie (σ*1, dritte Linie von oben).
In der Abbildung links ist noch einmal das σ2-Orbital gezeigt. Dies hatte sich formal aus s- und p-Orbitalen an den Kohlenstoff-Atomen und den s-Orbitalen der beiden Wasserstoffatome zusammengesetzt. Dabei ergab sich aus der Mischung der s- und p-Orbitale am Kohlenstoff ein nach außen gerichtetes spn-Orbital (siehe Kapitel 12). Die beiden spn-Orbitale sind mit Ihren kleinen Orbitallappen zueinander antibindend und mit ihrern großen Orbitallappen bindend zu den Wasserstoffatomen. Sie machen demnach einen Großteil der Kohlenstoff—Wasserstoff-Bindung aus.


Abbildung des bindenden σ2-Orbitals (links) und des korrespondieren antibindenden
σ*1-Orbitals (rechts). Durch Zählen der unterschiedlich gefärbten Orbitallappen,
ergeben sich für das linke Orbital eine Knotenebene, das rechte antibindende Orbital besitzt
drei Knoten.
Rechts ist das dazugehörige σ*-Orbital, dass σ*-Orbital (dritte Linie von oben) gezeigt. Genau wie das links abgebildete σ-Orbital hat es zwei nach außen gerichtete spn-Orbitale, die wie links eine antibindende Wechselwirkung besitzen. Im Gegensatz zum σ-Orbital, bei dem die C—H-Wechselwirkung bindend ist, handelt es sich hier um eine antibindende Wechselwirkung. Die Lücken zwischen den Elektronenwolken an den C—H-Bindungen verdeutlich die zwei zusätzlichen Knoten.
Es soll noch einmal darauf hingewiesen werden, dass hier das σ*1-Orbital und σ-2-Orbital statt dem σ*1- und σ1-Orbital zueinander passen.
Die σ*-Orbitale - Orbital 2
In diesem Abschnitt wird das zweite σ*-Orbital, das obere grüne Orbital diskutiert(σ*2). In der Abbildung unten links ist noch einmal das entsprechende σ-Orbital, dass σ3-Orbital gezeigt.
- Wählen Sie jeweils das σ3-Orbital (grün) und das σ*2-Orbital aus.
- Nutzen Sie die Zoomfunktion (Mausrad), um beide Orbitale in vollständig zu betrachten.
- Verkleinern und vergrößern Sie Atom- und Orbitalradius und zählen Sie die Knoten.
Das σ3-Orbital setzt sich bindend aus den beiden 2pz-Orbitalen der Kohlenstoffatome und ebenfalls bindend aus den 1s-Orbitalen der Wasserstoffatome zusammen (siehe Kapitel 13).


Abbildung des bindenden σ3-Orbitals (links) und das dazu passende
σ*2-Orbitals(rechts). Durch Zälen der unterschiedlich gefärbten Orbitallappen,
ergeben sich für das linke Orbital zwei Knotenflächen senkrecht durch die Kohlenstoffatome.
In der rechten Abbildung lassen sich sogar fünf Knoten erkennen.
Das rechts gezeigte σ*-Orbital ist sehr ähnlich aufgebaut. Wieder gibt es eine bindende C—C-Wechselwirkung durch die 2pz-Orbitale der Kohlenstoffatome. Allerdings gibt es im Gegensatz zum σ-Orbital eine antibindende Wechselwirkung zu den beiden 1s-Orbitalen der Wasserstoffatome.
Die σ*-Orbitale - Orbital 3
In diesem Abschnitt soll abschließend das σ*3-Orbital diskutiert werden. Zum Vergleich ist links unten noch einmal das σ1-Orbital abgebildet.
- Wählen Sie wie schon in Kapitel 10 das σ1-Orbital (blaue Linie) aus.
- Verkleinern Sie erneut das MO und drehen Sie das Molekül seitlich.
- Aktivieren Sie aus dieser Position nun das σ*3-Orbital (oberste blaue Linie).
- Drehen Sie das Molekül mehrfach und vergleichen Sie die beiden MO's indem Sie zwichen ihnen wechseln.
- Tipp: Um alle Unterschiede vollständig zu erfassen, lohnt es sich den MO-Radius bei Betrachtung des σ*-Orbitals stark zu vergrößern.
Das σ1-Orbital entsteht aus der bindenden Wechselwirkung von zwei nach innen gerichteten 2spn-Orbitalen an den Kohlenstoffen und ist so für die bindende C—C-Wechselwirkung verantwortlich. Zuätzlich gibt es eine schwache nindende C—H-Wechselwirkung, die in dieser Abbildung nicht zu erkennen ist (siehe Kapitel 10 und Kapitel 11).


Abbildung des bindenden σ1-Orbitals (links) und des korrespondieren antibindenden
σ*3-Orbitals (rechts). Anhand der unterschiedlich gefärbten Orbitallappen,
erkennt man einen zusätzlichen Knoten zwischen der C—C-Bindung und zwei weitere durch
die C—H-Bindungsachse.
Das σ*3-Orbital ist ähnlich aufgebaut. Wieder gibt es nach innen gerichtete 2spn-Orbitalen an den Kohlenstoffatomen, diese zeigen hier aber eine antibindende Wechselwirkung.
Im Gegensatz zum σ1-Orbital gibt es hier relativ große Orbitalkoeffizienten am Wassertsoff. Auch hier ist die Wechselwirkung antibindend.
Das σ*3-Orbital ist also C—H- und C—C-antibindend.
Zusammenfassung
Betrachtet man Ethin in einem LCAO-MO Ansatz, so ergeben sich speziell im σ-Gerüst komplexe bindende und antibindende MOs.
Benutzt man das Konzept der Hybridisierung, so ist das Bild einfacher. Man erhät an jedem Kohlenstoffatom zwei 2sp-Orbitale, jeweils eines wird zur Bildung der C—C-Bindung genutzt, das jeweils andere zur Bildung einer C—H-Bindung. In diesem Bild ergeben sich lokalisierte Bindungen. Dies entspricht unserer Vorstellung in der Lewisschreibweise, in der jeder Strich ein lokalisiertes Elektronenpaar darstellt.
Daher ist die Hybridisierung eine wertvolle Modellvorstellung. Man darf aber nie vergessen, dass die Hybridisierung keine physikalische Realität zu Grunde liegt. Für genauere Betrachtungen muss man die MO-Theorie heranziehen. Betrachtet man Orbitalenergien so findet man tatsächlich drei verschiedene σ-Orbitale
Aus geometrischen Gründen kann im Ethin keine Vermischung der px- und py-Orbitale mit den übrigen Orbitalen stattfinden. Daher sind die Orbitale im π-System in der Modellvorstellung der Hybridsierung und in der MO-LCAO-Methode sehr ähnlich.
 σ-Kohlenstoffbindung
σ-Kohlenstoffbindung
 erstes π-Orbital (py)
erstes π-Orbital (py)
 erstes π*-Orbital (py)
erstes π*-Orbital (py)
 zweites π-Orbital (px)
zweites π-Orbital (px)
 zweites π*-Orbital (px)
zweites π*-Orbital (px)
Die 3D-Animationen auf dieser Seite wurden mit Hilfe von JSmol erstellt: an open-source Java viewer for chemical structures in 3D. http://www.jmol.org/
scheLM 3D
scheLM Gl
scheLM I4
scheLM IR
scheLM n2s
scheLM NMR
scheLM PSE
scheLM ReRe
scheLM TV
scheLM tys
scheLM Vote
Auszeichnungen Personen Datenschutz Impressum
Wir danken dem eLearning-Förderfonds der Heinrich-Heine-Universität und dem Lehrförderungsfond der Heinrich-Heine-Universität, sowie dem Fellowship Digitale Innovation in der Hochschullehre des Landes Nordrhein-Westfalen, sowie OER-Content.NRW für die Unterstützung.
© Copyright 2013 bis 2025, PD Dr. Klaus Schaper


