Bitte Warten
Das Laden der Strukturdaten dauert einen Augenblick. Bitte haben Sie etwas Geduld!
0 von 0 Strukturen wurden bereits geladen.
Es ist aber wahrscheinlich, dass sich beim Umzug doch das ein oder andere Problem eingeschlichen hat. Bitte meldet Probleme inkl. möglicht genauer Beschreibung und evtl. eines Screenshots an Klaus Schaper.
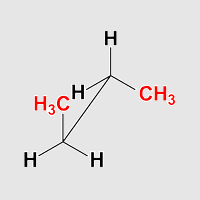
Animation der Konformationen im Butan
Studienfach:
Alle_Veranstaltungen
Lernziel
Die Studierenden sollen die Konformationen des Butans
(synperiplanar, gauche (synklinal), antiklinal und
antiperiplanar) in den verschiedenen Darstellungen
(Keilstrich-Projektion, Sägebock-Projektion und
Newman-Projektion) erkennen, benennen und zeichnen können.
Dieses Modul baut auf dem vorangegangenen Modul
Ethan auf.
Konformationen des Butans
Verglichen mit dem Ethan
ist die Situation im Butan komplizierter.
Es gibt wieder drei gestaffelte Konformationen, von denen aber eine
günstiger als die beiden anderen ist.
Ähnlich gibt es auch ein ekliptisches Konformer welches,
sich von den beiden anderen ekliptischen Konformeren unterscheidet.
Dieses einzelne Konformer ist energetisch ungünstiger als die
beiden Anderen.
Starten Sie die Animation und betrachten Sie die konformellen Änderungen. Verfolgen Sie die energetischen Änderungen.
In der Startgeometrie
stehen die beiden Methylgruppen an der mittleren Einfachbindung
synperiplanar zueinander. Die Einfachbindungen C1-C2 und C3-C4 stehen
direkt hintereinander, wenn Sie entlang der Bindungsachse
C2-C3 schauen (C1 bezeichnet das erste Kohlenstoffatom der Kette,
C2 das zweite Kohlenstoffatom der Kette, usw. Dabei spielt es
keine Rolle, aus welcher Richtung man die Zählung vornimmt.).
Der Dihedralwinkel beträgt 0°. Es handelt sich um eine
ekliptische Anordnung.
Der Wortbestandteil planar weist darauf hin, dass die Atome
C1, C2, C3 und C4 in einer Ebene stehen, der Wortbestandteil
peri kommt aus dem altgriechischen und steht für
näherungsweise. Periplanar bedeutet daher
näherungsweise planar. Die Vorsilbe syn kommt
ebenfalls aus dem altgriechischen und bedeutet zusammen.
In der synperiplanaren stehen die vier Kohlenstoffatome
also näherungsweise (hier exakt) in einer Ebene und Sie
stehen auf der gleichen Seite des Moleküls.
Drehen Sie das Molekül in der synperiplanaren Anordnung so, dass die Orientierung einer Keilstrich-Projetion, einer Sägebock-Projektion und einer Newman-Projektion entspricht.
Neben der synperiplanaren Anordnung gibt es eine weitere Anordnung, bei der alle vier Kohlenstoffatome in einer Ebene stehen. Hier stehen die beiden Kohlenstoffatome aber anti zueinander. Auch anti leitet sich aus dem altgriechischen ab und steht für gegenüber. Daher bezeichnet man die entsprechende Anordnung als antiperiplanar. Der Dihedralwinkel ist 180°. Es handelt sich um eine gestaffelte Anordnung.
Starten Sie die Animation und halten Sie die Animation in der antiperiplanaren Anordnung an . Drehen Sie das Molekül so, dass die Orientierung einer Keilstrich-Projetion, einer Sägebock-Projektion und einer Newman-Projektion entspricht.
 Sägebock Projektion
Sägebock Projektion
Butan synperiplanar
 Sägebock Projektion
Sägebock Projektion
Butan synklinal
 Sägebock Projektion
Sägebock Projektion
Butan antiklinal
 Sägebock Projektion
Sägebock Projektion
Butan antiperiplanar
Bei den zwei weiteren Konformationen stehen die vier Kohlenstoffatome nicht in einer Ebene.
Die Konformation bei einem Dihedralwinkel von ca. 60° (eine gestaffelte Anordnung) wird als synklinal bezeichnet. Syn, da die beiden Methylgruppen wie in der synperiplanaren Anordnung wieder auf einer Seite des Moleküls stehen. Klinal leitet sich vom altgriechischen ab und bedeutet "schief stehen", "nach links oder rechts tendieren". Eine synklinale Anordnung bezeichnet also eine schiefstehende, verdrillte Anordnung, die sich von der synperiplanaren Anordnung ableitet. Diese Anordnung wird auch als gauche bezeichnet. Dies leitet sich von dem französischen Wort gauchir (verdrillt) ab.
Starten Sie die Animation und halten Sie die Animation in der synperiplanaren (gauche) Anordnung an . Drehen Sie das Molekül so, dass die Orientierung einer Keilstrich-Projetion, einer Sägebock-Projektion und einer Newman-Projektion entspricht.
Die vierte Konformation ist die antiklinale Anordnung. Diese leitet sich von der antiperiplananren Anordnung ab. Wie die synklinale Konformation durch Verdrillung der synperiplanaren Konformation entsteht, so entsteht die antiklinale Anordnung durch Verdrillung der antiperiplanaren Anordnung. Der Dihedralwinkel beträgt 120°.
Starten Sie die Animation und halten Sie die Animation in der antiklinal Anordnung an . Drehen Sie das Molekül so, dass die Orientierung einer Keilstrich-Projektion, einer Sägebock-Projektion und einer Newman-Projektion entspricht.
Im Butan beobachtet man zwei verschiedene ekliptische Anordnungen, die synperiplanare und die antiklinale. Wie auch beim Ethan bilden die ekliptischen Anordnungen lokale Maxima auf der Energiekoordinate. Dabei ist die synperiplanare Anordnung ungünstiger als die antiklinale. Dies kann auf die sterische Wechselwirkung der Methylgruppen zurüchgeführt werden. In der synperiplanaren Anordnung stehen die "großen" Methylgruppen näher beieinander und behindern sich stärker. Dies wird besonders dann deutlich, wenn Sie die Atome zur vollen Ausdehnung vergrößern.
Drehen Sie das Molekül noch einmal in die antiklinale und die synperiplanare Anordnung und vergrößern Sie die Atome zur vollen Ausdehnung.
Ebenso wie es im Butan zwei verschiedene ekliptische Anordnungen
gibt, so existieren auch zwei gestaffelte. Es handelt sich
um die synklinale (gauche) und die antiperiplanare
Anordnung. Beide bilden wie im
Ethan
lokale Minima auf der Energiekurve. Hier ist die
antiperiplanare Anordnung günstiger, weil die
Methylgruppen weiter voneinander entfernt sind.
Daher liegen lange Alkanketten bevorzugt in der
Zickzack-Anordnung vor.
Drehen Sie das Molekül noch einmal in die synklinale und die antiperiplanare Anordnung und vergrößern Sie die Atome zur vollen Ausdehnung.
Im Ethan ist der Dihedralwinkel der gestaffelten Konformation bei exakt 60°. Im Butan ist der Dihedralwinkel der synklinalen Anordnung mit 70° bis 75° größer. Die Methylgruppe an einem Kohlenstoff steht in der Newman-Projektion zwischen der Methylgruppe und einem Wasserstoffatom am anderen Kohlenstoffatom. Die Abstoßung durch die Methylgruppe ist größer als durch das Wasserstoffatom. Daher ist der Winkel aufgeweitet.
 Newman Projektion
Newman Projektion
Butan synperiplanar
 Sägebock Projektion
Sägebock Projektion
Butan synperiplanar
 Keilstrich Projektion
Keilstrich Projektion
Butan synperiplanar
Die 3D-Animationen auf dieser Seite wurden mit Hilfe von JSmol erstellt: an open-source Java viewer for chemical structures in 3D. http://www.jmol.org/
scheLM 3D
scheLM Gl
scheLM I4
scheLM IR
scheLM n2s
scheLM NMR
scheLM PSE
scheLM ReRe
scheLM TV
scheLM tys
scheLM Vote
Auszeichnungen Personen Datenschutz Impressum
Wir danken dem eLearning-Förderfonds der Heinrich-Heine-Universität und dem Lehrförderungsfond der Heinrich-Heine-Universität, sowie dem Fellowship Digitale Innovation in der Hochschullehre des Landes Nordrhein-Westfalen, sowie OER-Content.NRW für die Unterstützung.
© Copyright 2013 bis 2024, PD Dr. Klaus Schaper


