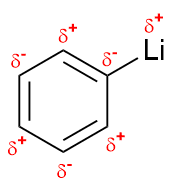
 Der +I-Effekt wird durch Substituenten mit einer geringerer Elektronegativität als
Wasserstoff ausgeübt; der Substituent ist partiell positiv geladen. Die positive Partialladung induziert an dem
mit dem Substituenten verbundenen Kohlenstoff eine negative Ladung. Diese Partialladung beeinflusst
wiederum die Ladungsverteilung in den mit diesem Atom verknüpften Atomen. Folgende Gruppen besitzen
einen elektronenschiebenden induktiven Effekt: Alkylgruppen (–CR3),
Silane (–SiR3), Borane (–BR2) oder Metalle wie Lithium, Magnesium oder Zink (–M).
Der +I-Effekt wird durch Substituenten mit einer geringerer Elektronegativität als
Wasserstoff ausgeübt; der Substituent ist partiell positiv geladen. Die positive Partialladung induziert an dem
mit dem Substituenten verbundenen Kohlenstoff eine negative Ladung. Diese Partialladung beeinflusst
wiederum die Ladungsverteilung in den mit diesem Atom verknüpften Atomen. Folgende Gruppen besitzen
einen elektronenschiebenden induktiven Effekt: Alkylgruppen (–CR3),
Silane (–SiR3), Borane (–BR2) oder Metalle wie Lithium, Magnesium oder Zink (–M).
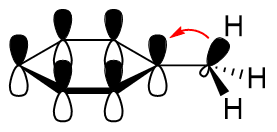 Einen Sonderfall stellen hierbei die Alkylsubstituenten dar. Der von ihnen hervorgerufene
elektronenschiebende Effekt beruht nicht ausschließlich auf der geringeren Elektronegativität eines
sp3-Kohlenstoffes – im Vergleich zu jener eines sp2-Cs –,
sondern auch auf der Konjugation zwischen dem π-System des betrachteten chemischen Grundkörpers
und den Elektronen der C–R-σ-Bindung im Substituenten. Dieser Effekt der
Hyperkonjugation
ist nebenstehend am Beispiel von Toluol dargestellt.
Einen Sonderfall stellen hierbei die Alkylsubstituenten dar. Der von ihnen hervorgerufene
elektronenschiebende Effekt beruht nicht ausschließlich auf der geringeren Elektronegativität eines
sp3-Kohlenstoffes – im Vergleich zu jener eines sp2-Cs –,
sondern auch auf der Konjugation zwischen dem π-System des betrachteten chemischen Grundkörpers
und den Elektronen der C–R-σ-Bindung im Substituenten. Dieser Effekt der
Hyperkonjugation
ist nebenstehend am Beispiel von Toluol dargestellt.
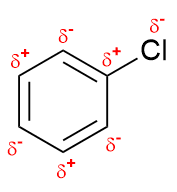 Substituenten mit einer höheren Elektronegativität als Wasserstoff üben den elektronenziehenden
–I-Effekt aus. Im Gegensatz zum +I-Effekt entsteht auf dem Substituenten eine negative
Partialladung, welche bei den angrenzenden Atomen eine partielle Positivierung hervorruft.
Solche Gruppen sind beispielsweise Halogene (–X), Alkohole (–OH),
Mercaptane (–SH), Amine (–NH2) oder Nitrogruppen (–NO2)
sowie ungesättigte Kohlenstoffsubstituenten.
Substituenten mit einer höheren Elektronegativität als Wasserstoff üben den elektronenziehenden
–I-Effekt aus. Im Gegensatz zum +I-Effekt entsteht auf dem Substituenten eine negative
Partialladung, welche bei den angrenzenden Atomen eine partielle Positivierung hervorruft.
Solche Gruppen sind beispielsweise Halogene (–X), Alkohole (–OH),
Mercaptane (–SH), Amine (–NH2) oder Nitrogruppen (–NO2)
sowie ungesättigte Kohlenstoffsubstituenten.